Este capitulo aborda los principales criterios utilizados para la elección de un solvente o un sistema solvente como lo es : Poder solvente, velocidad de Evaporación y Propiedades relativas a la seguridad.
PODER SOLVENTE
El poder solvente es la facilidad o la capacidad para disolver diversos ligantes.
El poder solvente está relacionado con la estructura química del disolvente y del polimero a disolver. Sus manifestaciones más características son estas:
- Un poder solvente elevado implica una velocidad de disolución tambien elevada.
- Los líquidos de moléculas pequeñas son mejores disolventes que los de moléculas grandes y, en general, proporcionan disoluciones de menor viscosidad. Así, en una serie homóloga hay una disminución del poder disolvente y un incremento de la viscosidad al aumentar el peso molecular.
- El poder disolvente varía con la temperatura.La reducción de la sensibilidad de las soluciones a las bajas temperaturas es otro efecto de los disolventes fuertes.
- Para una determinada proporción disolvente/polimero, la viscosidad final de la solucion es tanto mas baja cuanto mayor sea el poder solvente.
- Al reposar, algunas soluciones tienden a depositar material insoluble. Un disolvente potente reduce o anula esta sedimentación.
- Una proporción excesiva del disolvente puede hacer precipitar el ligante en solución. Una potencia solvente elevada permite una mayor disolución sin que aparezcan precipitaciones.
- Cuando a una resina se añade un liquido en el que la resina no es totalmente soluble(un diluyente, por ejemplo) llega un momento en que la resina se insolubiliza. La concentración de no-disolvente admisible crece con la potencia solvente del disolvente usado.
El poder solvente constituye una manifestación del complicado proceso de disolución de los polimeros, que incluye diversas fases: solvatación, gasificación, dispersión... Las diferencias de poder solvente entre dos líquidos indican comportamientos cualitativamente distintos; la diferencia entre sus propiedades no será sólo una cuestión de grado.
1. Viscosidad
Los gases y los líquidos tienen una propiedad conocida como la viscosidad, la cual se puede definir como la resistencia a fluir ofrecida por un liquido, resultante de los efectos combinados de la cohesión y la adherencia. La viscosidad se produce por el efecto de corte o deslizamiento resultante del movimiento de una capa de fluido con respecto a otro y es completamente distinta de la atracción molecular. Se puede considerar como causada por la fricción interna de las moléculas y se presenta tanto en gases ideales como en líquidos y gases reales.
Dicho concepto se introdujo anteriormente en la Ley de Newton, que relaciona el esfuerzo cortante con la velocidad de deformación (gradiente de velocidad).
(ecuación 1)
t=m.D
donde,
t : esfuerzo cortante [mPa].
m : viscosidad [mPa·s]
D: velocidad de deformación [s-1]
1.1 Tipos de viscosidad
Existen tres tipos de viscosidad : la viscosidad dinámica, la viscosidad cinemática y la viscosidad aparente.
La viscosidad dinámica o absoluta, denominada “m” se ha visto anteriormente en la ecuación 1.Si se representa la curva de fluidez (esfuerzo cortante frente a velocidad de deformación) se define también como la pendiente en cada punto de dicha curva.
En cambio, la viscosidad aparente “m” se define como el cociente entre el esfuerzo cortante y la velocidad de deformación. Este término es el que se utiliza al hablar de “viscosidad” para fluidos no newtonianos (figura 1).
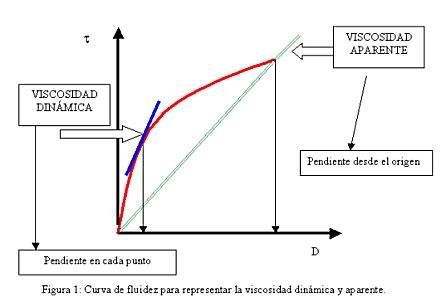 Por último existe otro término de viscosidad “n“ denominado viscosidad cinemática, que relaciona la viscosidad dinámica con la densidad del fluido utilizado. Las unidades más utilizadas de esta viscosidad son los centistokes [cst].
Por último existe otro término de viscosidad “n“ denominado viscosidad cinemática, que relaciona la viscosidad dinámica con la densidad del fluido utilizado. Las unidades más utilizadas de esta viscosidad son los centistokes [cst].
1 stoke = 100 centistokes = cm2/s
Su ecuación es la siguiente: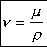
Siendo:
n : viscosidad cinemática.
u : viscosidad dinámica .
p: densidad del fluido.
1.2 Relación viscosidad-poder disolvente
Esto no significa que el disolvente que proporciona la menor viscosidad sea el más adecuado. En disoluciones muy diluidas, si el disolvente disuelve mal al polímero, la cadena de este está enrollada y la disolución es poco viscosa. Por el contrario si el poder disolvente es elevado, las macromoléculas están extendidas proporcionando una mayor viscosidad. Sin embargo, en disoluciones concentradas las moléculas del polímero se agregan y el mejor disolvente es el que proporciona la menor viscosidad.
1.3. Relación viscosidad-tensión superficial
Otro factor a tener en cuenta es la tensión superficial del disolvente. Esta influye en el brillo, en la textura de la superficie, en la flotación de los pigmentos y en la adherencia de la película. La flotación de pigmentos es un fenómeno en el cual, si hablamos de la pintura por ejemplo, la pintura que contiene dos o más pigmentos se seca de tal manera que uno de ellos se separa de los otros (dispersión no homogénea) y se concentra en forma de rayas sobre la superficie de la película (flota). El disolvente o mezcla de disolventes debe evitar este problema.
Los disolventes tienen tensiones superficiales que oscilan de 18 dinas/cm para los hidrocarburos alifáticos hasta 30 dinas/cm para los disolventes oxigenados. Estos valores son inferiores a la tensión superficial de la mayoría de los polímeros. Como consecuencia el disolvente disminuye la tensión superficial, moja la superficie del polímero y facilita la formación de la película. Si la formación de la película es buena hay mayor humectación de la superficie, lo que es esencial para una buena adherencia. Esto se debe a que las moléculas se aproximan lo suficiente para que se formen enlaces de adherencia (enlaces intermoleculares entre la superficie y las moléculas de resina). Varios recubrimientos se aplican como dispersiones en agua y dado que el agua tiene una tensión superficial muy elevada de 72,7 dinas/cm es necesario añadir tensoactivos para que esta disminuya.
VELOCIDAD DE EVAPORACIÓN
Los solventes constituyen un grupo heterogéneo de hidrocarburos volátiles derivados de petróleo y del gas cuyo punto de ebullición es bajo por lo que se evaporan al entrar en contacto con el aire.
La otra característica básica de un disolvente es su velocidad de evaporación . No se trata de una propiedad simple: es el resultado de la acción conjunta de muchas otras.
La velocidad de evaporación “intrínseca “(en laboratorio) depende de un conjunto de factores, de los que los más importantes son éstos:
- Tensión de vapor del disolvente.
- Calor latente de vaporización.
- Conductividad térmica
- Calor especifico.
La practica industrial ha impuesto la clasificación de los disolventes por su volatilidad. Se distingue entre:
- Disolventes ligeros; tienen una velocidad de evaporación muy elevada. Suelen tener puntos de ebullicion inferiores a 100°C .ejemplos: acetona, metiletil-cetona, acetato de etilo, tolueno.
- Disolventes medios: Tienen una velocidad de evaporación media. Sus puntos de ebullición oscilan normalmente entre 100°C y 150°C. Ejemplos: xileno, ciertas naftas.
- Disolventes pesados. Son muy pocos volátiles .Sus puntos de ebullición suelen ser altos. Ejemplos: isoforona, butilglicol.
PROPIEDADES RELATIVAS A LA SEGURIDAD
Los disolventes orgánicos son productos peligrosos: son tóxicos, inflamables y explosivos en ciertas condiciones .En consecuencia deben tomarse las máximas precauciones cuando se utilizan .
-Inflamabilidad, toxicidad, olor y recuperación
Además de las propiedades técnicas que hacen que un disolvente sea adecuado para una aplicación particular, hay diversos factores, como la toxicidad e inflamabilidad, con las que se decide si es aceptable su uso.
La mayoría de los disolventes no clorados son inflamables a temperaturas ordinarias y representan un riesgo de fuego y explosión (los compuestos halogenados no arden, son ignífugos). Hay una legislación que reglamenta su almacenamiento, transporte y uso. Los disolventes con temperaturas de inflamación, Ti, menor de 23 °C presentan un riesgo de incendio elevado, entre 23 °C y 60 °C moderado y por encima de 60 °C el riesgo es ligero.
Los disolventes clorados constituyen un riesgo para la salud y su concentración máxima en aire está restringida para los trabajadores. El olor desagradable también puede descalificar a un disolvente.
La recuperación del disolvente es otro factor a tener en cuenta desde el punto de vista ambiental y económico.
Aquí un pequeño video de las precauciones al usar solventes , en este caso limpiadores.

BARRIENTOS: LES FALTO PONER MAS EJEMPLOS DE CULES SON LOS MEJORES SOLVENTES
ResponderEliminarHola me parece buena esta entrada ya que con eso nos da a conocer las propiedades de los solventes y asi poder caracterizarlos y tambien parece muy didactico los videos para un mayor entendimiento del tema.
ResponderEliminarInteresante la parte de que criterios de eleccion de un solvente y los videos sobre viscocidad y como la relacionan con la ley de newton q tocamos ese tema en el curso de fenomenos de transporte.
ResponderEliminarbuenos videos,pero mas k describir las propiedades debieron enfeatizar como estas influyen en el uso y caracteristicas de los solventes
ResponderEliminaradecuado video para poder elegir cuando,como y donde se utilizan los diferentes tipos de solventes y tambien como preservarlos para su mayor cuidado,evitando así accidentes y contaminación del medio.
ResponderEliminarla explicacion de las propiedades estuvo buena , pero se generalizaron y no se podria saber que solvente usar para un caso especifico, ya que faltan ejemplos.
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarMe parece buena la explicación, sin embargo creo que esto debería ser de la sección PROPIEDADES FISICOQUÍMICAS, ya que no explicaron de qué manera interviene un solvente en su aplicación. Atte PERCY LEITH - LOS ANFÓTEROS.
ResponderEliminarEsta informacion es mas sobre propiedades fisicoquimicas, tal vez con algun ejemplo en el cual se comparen solventes para un determinado uso seria lo mejor
ResponderEliminarMe parece muy importante esta información, considero que la principal elección que debe hacer una persona para elegir un solvente se da en el tema de seguridad. Antes de utilizar un determinado solvente se deben de conocer sus propiedades fisicoquímicas, como también su inflamabilidad y toxicidad, una mala manipulación de un determinado disolvente inflamable o tóxico puede causar la muerte.
ResponderEliminar